Síndrome de Down
(Redirigido desde «Sindrome de down»)
| Síndrome de Down | ||
|---|---|---|
 |
||
| Clasificación y recursos externos | ||
| Especialidad | Genética médica | |
| CIE-10 | Q90 | |
| CIE-9 | 758.0 | |
| CIAP-2 | A90 | |
| OMIM | 190685 | |
| DiseasesDB | 3898 | |
| MedlinePlus | 000997 | |
| eMedicine | ped/615 | |
| MeSH | D004314 | |
| Sinónimos | ||
|
||
| [editar datos en Wikidata] | ||
No se conocen con exactitud las causas que provocan el exceso cromosómico, aunque se relaciona estadísticamente con una edad materna superior a los 35 años. Las personas con síndrome de Down tienen una probabilidad superior a la de la población general de padecer algunas enfermedades, especialmente de corazón, sistema digestivo y sistema endocrino, debido al exceso de proteínas sintetizadas por el cromosoma de más. Los avances actuales en el descifrado del genoma humano están develando algunos de los procesos bioquímicos subyacentes a la discapacidad cognitiva, pero en la actualidad no existe ningún tratamiento farmacológico que haya demostrado mejorar las capacidades intelectuales de estas personas.2 Las terapias de estimulación precoz y el cambio en la mentalidad de la sociedad, por el contrario, sí están suponiendo un cambio positivo en su calidad de vida.
Índice
Historia
Lady Cockburn y sus hijos, de sir Joshua Reynolds. El niño a la espalda de lady Cockburn presenta algunos rasgos compatibles con SD.
El primer informe documentado de un niño con SD se atribuye a Étienne Esquirol en 1838,6 denominándose en sus inicios “cretinismo”7 o “idiocia furfurácea”. P. Martin Duncan en 1886 describe textualmente a “una niña de cabeza pequeña, redondeada, con ojos achinados, que dejaba colgar la lengua y apenas pronunciaba unas pocas palabras”.8
En ese año el médico inglés John Langdon Down trabajaba como director del Asilo para Retrasados Mentales de Earlswood, en Surrey, realizando un exhaustivo estudio a muchos de sus pacientes. Con esos datos publicó en el London Hospital Reports un artículo titulado: “Observaciones en un grupo étnico de retrasados mentales” donde describía pormenorizadamente las características físicas de un grupo de pacientes que presentaban muchas similitudes, también en su capacidad de imitación y en su sentido del humor.
Las primeras descripciones del síndrome achacaban su origen a diversas enfermedades de los progenitores, estableciendo su patogenia con base en una involución o retroceso a un estado filogenético más “primitivo”.
Alguna teoría más curiosa indicaba la potencialidad de la tuberculosis para “romper la barrera de especie”, de modo que padres occidentales podían tener hijos “orientales” (o “mongólicos”, en expresión del propio Dr. Down, por las similitudes faciales de estos individuos con los grupos nómadas del centro de Mongolia). Tras varias comunicaciones científicas, finalmente en 1909 G. E. Shuttleworth menciona por primera vez la edad materna avanzada como un factor de riesgo para la aparición del síndrome.9 De camino a la denominación actual el síndrome fue rebautizado como “idiocia calmuca10 ” o “niños inconclusos”.
En cuanto a su etiología, es en el año 1932 cuando el oftalmólogo neerlandés Petrus Johannes Waardenburg hace referencia por vez primera a un reparto anormal de material cromosómico como posible causa del SD.11 En 1956 Tjio y Levan demuestran la existencia de 46 cromosomas en el ser humano y poco después, en el año 1959 Lejeune, Gautrier y Turpin demuestran que las personas con SD portan 47 cromosomas. (Esto último lo demostró de manera simultánea la inglesa Pat Jacobs, olvidada a menudo en las reseñas históricas).
En 1961 un grupo de científicos (entre los que se incluía un familiar del Dr. Down) proponen el cambio de denominación al actual “síndrome de Down”, ya que los términos “mongol” o “mongolismo” podían resultar ofensivos.12 En 1965 la OMS (Organización Mundial de la Salud) hace efectivo el cambio de nomenclatura tras una petición formal del delegado de Mongolia.13 El propio Lejeune propuso la denominación alternativa de “trisomía 21” cuando, poco tiempo después de su descubrimiento, se averiguó en qué par de cromosomas se encontraba el exceso de material genético.
Epidemiología
Tabla de riesgo por edad materna
El Estudio Colaborativo Español de Malformaciones Congénitas (ECEMC) informaba en el año 2004 de una prevalencia neonatal de 7,11 cada 10 000 recién nacidos, con tendencia a disminuir de manera estadísticamente significativa.15 Esta tendencia, junto con el aumento relativo de casos en mujeres por debajo de 35 años, se atribuye al aumento de interrupciones voluntarias del embarazo tras el diagnóstico prenatal en mujeres por encima de esa edad.16
Parece existir una relación estadística (sin que se conozcan los mecanismos exactos) entre algunas enfermedades maternas como hepatitis, Mycoplasma hominis tipo 1, Herpes simple tipo II y diabetes17 y un aumento en la incidencia de aparición de SD; no obstante esa relación estadística no es tan intensa como en el caso de la edad materna. Algún autor18 también ha relacionado la baja frecuencia coital, así como el uso de anovulatorios y espermicidas con la aparición del síndrome.
La probabilidad de tener un hijo con SD es mayor a la media para aquellos padres que ya han tenido otro previamente. Típicamente la probabilidad de tener otro hijo con SD en cada embarazo subsiguiente es de una por cada cien recién nacidos vivos, esto hay que ponderarlo para cada caso con el riesgo propio de la madre según su edad. Los antecedentes familiares igualmente incrementan ese riesgo.
Los varones con síndrome de Down se consideran estériles,19 pero las mujeres conservan con frecuencia su capacidad reproductiva. En su caso también se incrementa la probabilidad de engendrar hijos con SD hasta un 50 %, aunque pueden tener hijos sin trisomía.
Etiología
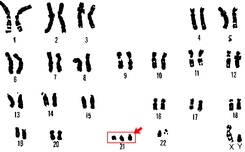
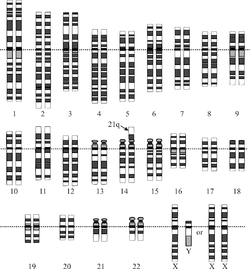
Las células del ser humano poseen cada una en su núcleo 23 pares de cromosomas. Cada progenitor aporta a su descendencia la mitad de la información genética, en forma de un cromosoma de cada par. 22 de esos pares se denominan autosomas y el último corresponde a los cromosomas sexuales (X o Y).Tradicionalmente los pares de cromosomas se describen y nombran en función de su tamaño, del par 1 al 22 (de mayor a menor), más el par de cromosomas sexuales antes mencionado. El cromosoma 21 es el más pequeño, en realidad, por lo que debería ocupar el lugar 22, pero un error en la convención de Denver del año 1960, que asignó el síndrome de Down al par 21 ha perdurado hasta nuestros días, manteniéndose por razones prácticas esta nomenclatura.20
El cromosoma 21 contiene aproximadamente el 1% de la información genética de un individuo en algo más de 400 genes, aunque hoy en día sólo se conoce con precisión la función de unos pocos.
Trisomía libre
Código CIE-10: Q90.0El síndrome de Down se produce por la aparición de un cromosoma más en el par 21 original (tres cromosomas: “trisomía” del par 21) en las células del organismo. La nomenclatura científica para ese exceso cromosómico es 47, XX,+21 o 47, XY,+21; según se trate de una mujer o de un varón, respectivamente. La mayor parte de las personas con este síndrome (95%), deben el exceso cromosómico a un error durante la segunda división meiótica (aquella por la que los gametos, óvulos o espermatozoides, pierden la mitad de sus cromosomas) llamándose a esta variante, “trisomía libre” o regular. El error se debe en este caso a una disyunción incompleta del material genético de uno de los progenitores. (En la formación habitual de los gametos el par de cromosomas se separa, de modo que cada progenitor sólo transmite la información de uno de los cromosomas de cada par. Cuando no se produce la disyunción se transmiten ambos cromosomas). No se conocen con exactitud las causas que originan la disyunción errónea. Como en otros procesos similares se han propuesto hipótesis multifactoriales (exposición ambiental, envejecimiento celular…) sin que se haya conseguido establecer ninguna relación directa entre ningún agente causante y la aparición de la trisomía. El único factor que presenta una asociación estadística estable con el síndrome es la edad materna, lo que parece apoyar las teorías que hacen hincapié en el deterioro del material genético con el paso del tiempo.
En aproximadamente un 15% de los casos el cromosoma extra es transmitido por el espermatozoide y en el 85 % restante por el óvulo.21
Translocación
Translocación del brazo largo del cromosoma 21 en uno de los dos cromosomas del par 14.
Después de la trisomía libre, la causa más frecuente de aparición del exceso de material genético es la translocación. En esta variante el cromosoma 21 extra (o un fragmento del mismo) se encuentra “pegado” a otro cromosoma (frecuentemente a uno de los dos cromosomas del par 14), por lo cual el recuento genético arroja una cifra de 46 cromosomas en cada célula. En este caso no existe un problema con la disyunción cromosómica, pero uno de ellos porta un fragmento “extra” con los genes del cromosoma “translocado”. A efectos de información genética sigue tratándose de una trisomía 21 ya que se duplica la dotación genética de ese cromosoma.
La frecuencia de esta variante es aproximadamente de un 3 %22 de todos los SD y su importancia estriba en la necesidad de hacer un estudio genético a los progenitores para comprobar si uno de ellos era portador sin saberlo de la translocación, o si ésta se produjo por primera vez en el embrión. (Existen portadores “sanos” de translocaciones, en los que se recuentan 45 cromosomas, estando uno de ellos translocado, o pegado, a otro).
Mosaicismo
Código CIE-10: Q90.1La forma menos frecuente de trisomía 21 es la denominada “mosaico” (en torno al 2 %23 de los casos). Esta mutación se produce tras la concepción, por lo que la trisomía no está presente en todas las células del individuo con SD, sino sólo en aquellas cuya estirpe procede de la primera célula mutada. El porcentaje de células afectadas puede abarcar desde unas pocas a casi todas, según el momento en que se haya producido la segregación anómala de los cromosomas homólogos.
Expresión del exceso de material genético
La expresión bioquímica del síndrome consiste en el aumento de diferentes enzimas. Una de las más conocidas e importantes es la superóxido dismutasa (codificada por el gen SOD-1), que cataliza el paso del anión superóxido hacia peróxido de hidrógeno. En condiciones normales esto contribuye al sistema de defensa antioxidante del organismo, pero su exceso determina la acumulación de H2O2, lo que puede provocar peroxidación de lípidos y proteínas y dañar el ADN. Otros genes implicados en la aparición de trastornos asociados al SD son:24- COL6A1: su expresión incrementada se relaciona con defectos cardíacos
- ETS2: su expresión incrementada puede ser causa de alteraciones músculo esqueléticas
- CAF1A: la presencia incrementada de este gen puede interferir en la síntesis de ADN
- Cystathione Beta Synthase (CBS): su exceso puede causar alteraciones metabólicas y de los procesos de reparación del ADN
- DYRK: en el exceso de proteínas codificadas por este gen parece estar el origen de la discapacidad cognitiva
- CRYA1: su sobreexpresión puede originar cataratas (opacidad precoz del cristalino)
- GART: la expresión aumentada de este gen puede alterar los procesos de síntesis y reparación del ADN
- IFNAR : es un gen relacionado con la síntesis de interferón, por lo que su exceso puede provocar alteraciones en el sistema inmunitario.
Expresión génica diferencial expresada en dominios
En el año 2014 se publicó un estudio novedoso realizado a partir de los fibroblastos de gemelos monocigóticos discordantes para síndrome de Down. Uno de los gemelos padecía el síndrome y el otro no. Este hecho permitió estudiar la variabilidad genómica debida al síndrome de Down eliminando la variación genética entre muestras.El estudio del transcriptoma de dichos fibroblastos mostró diferencias en la expresión de 182 genes. Además se observó una menor expresión de proteínas implicadas en rutas de señalización y respuesta inflamatoria. Uno de los hechos más destacados es que se encontraron dominios cromosómicos bien definidos con distintos perfiles de expresión, alternando regiones de expresión aumentada con otras regiones de expresión disminuida. Tras estas observaciones se concluyó que la expresión génica diferencial en síndrome de down no se organiza aleatoriamente, si no que sigue un patrón específico a lo largo de los cromosomas. A estos dominios de expresión génica desregulada se les conoce como GEDDs (Gene expression dysregulation domains). En paralelo se realizó el estudio del transcriptoma de fibroblastos de gemelos monocigóticos sanos y no se observaron estos dominios GEDDs. La organización en dominios en los gemelos discordantes podría ser atribuida fundamentalmente a la copia extra del cromosoma 21. Además, la expresión génica en el contexto de célula trisómica podría estar menos afinada y ser menos dinámica.
Anteriormente a estos descubrimientos, se había descrito ya la organización en dominios de los cromosomas de mamíferos con la identificación de los LADs (Lamina associated domains) cuya característica fundamental era la inhibición generalizada de la expresión génica. Estas regiones presentan una baja densidad de genes y una expresión génica disminuida entre otras características. Los genes en LADs están sobreexpresados en el gemelo con síndrome de down, al contrario de los genes localizados fuera de los LADs. De la comparación entre estos dominios lámina-asociados y los GEDDs se obtuvieron dos conclusiones fundamentales, que la interacción genoma-lámina nuclear podría estar modificada en núcleos trisómicos (derepresión en células trisómicas) y que la topología de los dominios LADs no se perturba por la presencia de un cromosoma extra.
En cuanto al entorno cromatínico en estos dominios de expresión génica desregulada, no se observan cambios en la topología del genoma de los fibroblastos con síndrome de down, lo que sugiere la existencia de posibles modificaciones epigenéticas en los dominios cromosómicos de células trisómicas. La comparación de los cambios de metilación de ADN entre el gemelo sano y el gemelo con síndrome de down, y la posterior comparación con los GEDDs muestra que la alteración de la expresión génica no puede ser explicada completamente por los cambios en la metilación. Algunos estudios anteriores han descrito que el ciclo celular es más largo en el núcleo trisómico sin afectar al tiempo de replicación, esto resultaría en un mayor tiempo de cromatina abierta y por tanto un aumento en la transcripción. Por último, cambios en la actividad transcripcional podrían estar influenciados por cambios en las marcars de la cromatina como H3K4me3. Los GEDDs coinciden con modificaciones de histonas metiladas en fibroblastos trisómicos.
Como conclusión, se podría decir que la presencia de un pequeño fragmento de ADN extra en el genoma (1%) puede alterar el transcriptoma entero. Esto es interesante porque la perturbación de la regulación génica puede ser común a otras anomalías cromosómicas. Los mecanismos que están detrás de esta organización en dominios GEDDs pueden explicarse de dos formas: La sobreexpresión de uno o más genes del HSA21 modifica el entorno cromatínico del compartimento nuclear en células trisómicas, lo que alteraría el transcriptoma y daría lugar al los distintos fenotipos. La segunda explicación sería que los GEDDS aparezcan como resultado del material cromosómico extra en la trisomía del 21.
Cuadro clínico
Joven con síndrome de Down utilizando un destornillador eléctrico.
En cuanto al fenotipo han sido descritos más de 100 rasgos peculiares asociados al SD, pudiendo presentarse en un individuo un número muy variable de ellos. De hecho ninguno se considera constante o patognomónico aunque la evaluación conjunta de los que aparecen suele ser suficiente para el diagnóstico. La severidad y variabilidad de los distintos fenotipos en la población dependen en gran medida del fondo genético y epigenético del individuo.
Algunos de los rasgos más importantes son un perfil facial y occipital planos, braquiocefalia (predominio del diámetro transversal de la cabeza), hendiduras palpebrales oblicuas, diastasis de rectos (laxitud de la musculatura abdominal), raíz nasal deprimida, pliegues epicánticos (pliegue de piel en el canto interno de los ojos), cuello corto y ancho con exceso de pliegue epidérmico nucal, microdoncia, paladar ojival, clinodactilia del quinto dedo de las manos (crecimiento recurvado hacia el dedo anular), pliegue palmar único, y separación entre el primer y segundo dedo del pie. Las enfermedades que se asocian con más frecuencia son las cardiopatías congénitas y enfermedades del tracto digestivo (celiaquía, atresia/estenosis esofágica o duodenal, colitis ulcerosa...). Los únicos rasgos presentes en todos los casos son la atonía muscular generalizada (falta de un tono muscular adecuado, lo que dificulta el aprendizaje motriz) y la discapacidad cognitiva aunque en grados muy variables.29 Presentan, además, un riesgo superior al de la población general, para el desarrollo de enfermedades como leucemia (leucemia mieloide aguda), diabetes, hipotiroidismo, miopía, o luxación atloaxoidea (inestabilidad de la articulación entre las dos primeras vértebras, atlas y axis, secundaria a la hipotonía muscular y a la laxitud ligamentosa). Todo esto determina una media de esperanza de vida entre los 50 y los 60 años, aunque este promedio se obtiene de una amplia horquilla interindividual (las malformaciones cardíacas graves o la leucemia, cuando aparecen, pueden ser causa de muerte prematura). El grado de discapacidad intelectual también es muy variable, aunque se admite como hallazgo constante una discapacidad ligera o moderada. No existe relación alguna entre los rasgos externos y el desarrollo intelectual de la persona con SD.
| Características | Porcentaje de aparición30 | Características | Porcentaje de aparición |
|---|---|---|---|
| Discapacidad cognitiva | 100% | Microdoncia total o parcial | 60% |
| Retraso del crecimiento | 100% | Puente nasal deprimido | 60% |
| Dermatoglifos atípicos | 90% | Clinodactilia del 5º dedo | 52% |
| Diástasis de músculos abdominales | 80% | Hernia umbilical | 51% |
| Hiperlaxitud ligamentosa | 80% | Cuello corto | 50% |
| Hipotonía | 80% | Manos cortas/braquidactilia | 50% |
| Braquiocefalia/región occipital plana | 75% | Cardiopatía congénita | 45% |
| Genitales hipotróficos | 75% | Pliegue palmar transversal | 45% |
| Hendidura palpebral | 75% | Macroglosia | 43% |
| Extremidades cortas | 70% | Pliegue epicántico | 42% |
| Paladar ojival | 69% | Estrabismo | 40% |
| Oreja redonda de implantación baja | 60% | Manchas de Brushfield (iris) | 35% |
Enfermedades asociadas más frecuentes
Cardiopatías
Entre un 40 y un 50 % de los recién nacidos con SD presentan una cardiopatía congénita, es decir, una patología del corazón presente en el momento del nacimiento,31 siendo estas la causa principal de mortalidad en niños con SD. Algunas de estas enfermedades sólo precisan vigilancia para comprobar que su evolución es adecuada, mientras que otras pueden necesitar tratamiento quirúrgico urgente. Casi la mitad de ellas se corresponden con defectos del septo aurículo-ventricular (ausencia de cierre más o menos completa de la pared que separa aurículas y ventrículos). Una tercera parte (en torno al 30 % según las fuentes) son defectos de cierre del septo ventricular (pared que separa los ventrículos entre sí), y con menos frecuencia se encuentran otras enfermedades como ostium secundum,32 ductus arterioso persistente33 o tetralogía de Fallot.34En general casi todos estos defectos provocan paso inapropiado de sangre desde las cavidades izquierdas del corazón a las derechas, aumentando la circulación pulmonar. La tetralogía de Fallot, en cambio, provoca un cortocircuito inverso, por lo que disminuye el flujo sanguíneo pulmonar y aparece cianosis (color azulado por la deficiente oxigenación de la sangre), sobre todo en crisis de llanto o esfuerzos. Esta es una patología grave que precisa cirugía, habitualmente en el primer año de vida, para reparar los defectos. Es frecuente que el examen clínico del recién nacido no ofrezca datos de sospecha por lo que pueden quedar sin diagnosticar en la etapa neonatal hasta un 50 % de los recién nacidos con cardiopatía congénita. Por este motivo se recomienda la realización de una ecografía del corazón a todo recién nacido con SD.35 En la etapa de adolescencia o adulto joven pueden aparecer defectos en las válvulas cardíacas (Con mayor frecuencia, prolapso de la válvula mitral). Los adultos con SD presentan, en cambio, menor riesgo de arterioesclerosis y unas cifras de tensión arterial inferiores a las de la población general, por lo que se consideran un grupo poblacional protegido frente a enfermedad coronaria (angina de pecho, infarto de miocardio…).36
Diagrama de los defectos presentes en la tetralogía de Fallot: A.
Estenosis pulmonar, B. Aorta acabalgada, C. Defecto del septo
ventricular, D. Hipertrofia del ventrículo derecho.
|
Eco-Doppler demostrando insuficiencia mitral (incapacidad de la válvula
para cerrarse completamente, provocando regurgitación de sangre hacia la
aurícula izquierda, en azul. Esta patología valvular degenerativa puede
aparecer precozmente en personas con SD.
|
Alteraciones gastrointestinales
La frecuencia de aparición de anomalías o malformaciones digestivas asociadas al SD es muy superior a la esperada en población general: en torno al 10 % de las personas con SD presentan alguno de estos trastornos. La lista de anomalías y su expresión clínica (gravedad con la que se presentan) es muy amplia y variable, pero las que presentan una mayor incidencia son la atresia esofágica, la atresia o estenosis duodenal, las malformaciones anorrectales, el megacolon agangliónico (Enfermedad de Hirschsprung) y la celiaquía. La atresia esofágica consiste en la interrupción de la luz del esófago (este se encuentra “obstruido” por un desarrollo incompleto).El riesgo de aparición en niños con SD es casi 30 veces superior al de la población general, y precisa tratamiento quirúrgico precoz para impedir aspiración de saliva y alimento a la vía aérea y permitir el tránsito adecuado de alimentos hasta el estómago. Un cuadro similar se presenta en la atresia o estenosis duodenal (atresia: obstrucción total, estenosis: obstrucción parcial), pero en este caso en la porción de intestino situada inmediatamente tras el estómago. Puede deberse a una compresión mecánica del páncreas por una anomalía en su desarrollo denominada “páncreas anular”. Esta malformación (la atresia duodenal) aparece hasta en el 8% de los niños recién nacidos con SD.37 El ano imperforado es la malformación anorrectal más frecuente en niños con SD: se ha descrito una incidencia del 2-3%38 (es decir, dos o tres da cada cien niños recién nacidos con SD lo presentan), mientras que su aparición en la población general se estima en torno a uno de cada 5000. Su diagnóstico es clínico y su tratamiento quirúrgico. Otros trastornos relativamente frecuentes son el megacolon, o dilatación excesiva de la porción distal del tracto digestivo por un defecto en la relajación y la enfermedad celíaca (intolerancia digestiva al gluten), que aparecen también con una frecuencia superior a la que se presenta en recién nacidos sin el síndrome.
Trastornos endocrinos
Las personas con SD de cualquier edad tienen un riesgo superior al promedio de padecer trastornos tiroideos. Casi la mitad presentan algún tipo de patología de tiroides durante su vida. Suele tratarse de hipotiroidismos leves adquiridos o autoinmunes que en muchos casos no precisan tratamiento, aunque cuando su gravedad lo requiere deben instaurarse lo más precozmente posible para no ver comprometido el potencial de desarrollo intelectual.Trastornos de la visión
Más de la mitad (60 %) de las personas con SD presentan durante su vida algún trastorno de la visión susceptible de tratamiento o intervención. El astigmatismo, las cataratas congénitas o la miopía son las enfermedades más frecuentes. Dada la enorme importancia que la esfera visual supone para el aprendizaje de estos niños se recomiendan controles periódicos que corrijan de manera temprana cualquier déficit a este nivel.Trastornos de la audición
La particular disposición anatómica de la cara de las personas con SD determina la aparición frecuente de hipoacusias de transmisión (déficits auditivos por una mala transmisión de la onda sonora hasta los receptores cerebrales). Esto es debido a la presencia de enfermedades banales pero muy frecuentes como impactaciones de cerumen, otitis serosas, colesteatomas o estenosis del conducto auditivo, lo que ocasiona la disminución de la agudeza auditiva hasta en el 80 % de estos individuos.Trastornos odontoestomatológicos
Las personas con SD tienen una menor incidencia de caries, pero suelen presentar con frecuencia trastornos morfológicos por malposiciones dentarias, agenesia (ausencia de formación de alguna pieza dentaria), o retraso en la erupción dentaria. Son necesarias revisiones periódicas para una corrección precoz de los trastornos más importantes o que comprometan la función masticatoria o fonatoria.Inmunodeficiencia y susceptibilidad a las infecciones
Las personas con SD presentan ciertas anomalías inmunológicas de características e intensidad variables que no son fácilmente asimilables a las inmunodeficiencias catalogadas. Son la causa principal de la mayor susceptibilidad de estas personas a ciertas enfermedades infecciosas. Otros factores inherentes a SD contribuyen a ello: sus frecuentes contactos con otras personas con discapacidad funcional neurológica en centros de educación o atención especial, la intensa afectividad de estas personas y la frecuente coexistencia de otras anomalías, como las cardioptías, que también comportan un mayor riesgo o vulnerabilidad a las infecciones.39Las infecciones del tracto respiratorio representan a día de hoy la segunda causa de fallecimiento (tras las cardiopatías congénitas) y la primera causa de hospitalizaciones y complicaciones en niños con SD.39
Diagnóstico
Medición del pliegue nucal mediante ecografía convencional.
Para detectar la anormalidad cromosómica durante el periodo prenatal de forma inequívoca se emplean técnicas de conteo cromosómico, por lo que es necesario disponer de alguna célula fetal. El acceso al material celular embrionario puede suponer un cierto riesgo, tanto para la madre como para el feto, por lo que su indicación se circunscribe a aquellos embarazos en los que se haya detectado un riesgo de aparición de la trisomía superior al de la población general (triple prueba positiva, edad materna superior a 35 años o paterna superior a 50, antecedentes familiares o personales de SD, o progenitores portadores de una traslocación equilibrada u otras alteraciones cromosómicas).
La técnica más frecuentemente utilizada para la obtención de material genético fetal es la Amniocentesis. Esta técnica se empezó a generalizar en la década de los 60, y consiste en la punción ecoguiada de la cavidad amniótica por vía abdominal. Se consigue así una muestra de líquido amniótico, de donde es posible obtener células fetales para su estudio. Debe realizarse preferentemente entre las semanas 14 a 17 del embarazo. Es una técnica relativamente inocua y poco molesta pero comporta un riesgo del 1-2 % de aborto, lesión fetal, o infección materna.
A mediados de los 80 se comenzó a usar otra técnica, denominada Biopsia de vellosidades coriónicas: se obtiene un fragmento de material placentario por vía vaginal o a través del abdomen, normalmente entre las semanas 8 y 11 del embarazo. Esta técnica se puede realizar antes de que exista la suficiente cantidad de líquido amniótico necesaria para que se pueda llevar a cabo la amniocentesis, y el estudio cromosómico es más rápido pues no se necesita el cultivo celular para obtener una muestra suficientemente grande. Presenta un riesgo para la madre y el feto similar al de la amniocentesis.
Desde el año 2012 existe un test de determinación de ADN fetal en sangre materna que permite obtener resultados con una sensibilidad próxima al 100 % (aunque resultados positivos requieren confirmación mediante amniocentesis)40
Tratamiento
La mejoría en los tratamientos de las enfermedades asociadas al SD ha aumentado la esperanza de vida de estas personas, desde los 14 años hace unas décadas, hasta casi la normalidad (60 años, en países desarrollados) en la actualidad. A lo largo de los últimos 150 años se han postulado diferentes tratamientos empíricos (hormona tiroidea, hormona del crecimiento, ácido glutámico, dimetilsulfóxido, complejos vitamínicos y minerales, 5-Hidroxitriptófano o piracetam) sin que ninguno haya demostrado en estudios longitudinales a doble ciego que su administración provoque ningún efecto positivo significativo en el desarrollo motor, social, intelectual o de expresión verbal de las personas con SD. No existe hasta la fecha ningún tratamiento farmacológico eficaz para el SD, aunque los estudios puestos en marcha con la secuenciación del genoma humano permiten augurar una posible vía de actuación (enzimática o genética), eso sí, en un futuro todavía algo lejano.Los únicos tratamientos que han demostrado una influencia significativa en el desarrollo de los niños con SD son los programas de Atención Temprana, orientados a la estimulación precoz del sistema nervioso central durante los seis primeros años de vida. Especialmente durante los dos primeros años el SNC presenta un grado de plasticidad muy alto lo que resulta útil para potenciar mecanismos de aprendizaje y de comportamiento adaptativo.41 42 Los individuos con grandes dificultades para el aprendizaje a menudo han sido internados en instituciones, pero se ha comprobado que deben vivir en su domicilio, donde desarrollan de forma más completa todo su potencial. La adaptación curricular permite en muchos casos una integración normalizada en colegios habituales, aunque deben tenerse en cuenta sus necesidades educativas especiales. La edad mental que pueden alcanzar está todavía por descubrir, y depende directamente del ambiente educativo y social en el que se desarrollan. Cuando este es demasiado protector, los chicos y chicas tienden (al igual que ocurriría en una persona sin SD) a dejarse llevar, descubriendo escasamente sus potencialidades. Los contextos estimulantes ayudan a que se generen conductas de superación que impulsan el desarrollo de la inteligencia. Como consecuencia, es imposible determinar los trabajos y desempeños que pueden conseguir durante la vida adulta. Potenciar sus iniciativas y romper con los planteamientos estáticos que históricamente les han perseguido son compromisos sociales ineludibles que las sociedades actuales deben atender.
Recientemente, se ha publicado un ensayo clínico en el que se describe una moderada mejora con un tratamiento que combina la estimulación cognitiva con la administración de un compuesto presente en el té verde, la epigalocatequina galato. Un equipo multidisciplinar dirigido por los doctores Mara Dierssen y Rafael de la Torre ha demostrado que la epigalocatequina galato provoca una mejoría sensible en la capacidad intelectual y la salud física de los afectados. Dicho compuesto afecta al gen DYRK1A, relacionado con la formación del cerebro y sobreactivado por el cromosoma extra del síndrome de Down; este gen produce un exceso de proteínas asociadas a las alteraciones cognitivas que este compuesto devuelve a sus niveles normales.43
Atención temprana
Todos los niños precisan de estímulos para el correcto desarrollo de sus capacidades motrices, cognitivas, emocionales y adaptativas. Los niños con SD no son una excepción, aunque sus procesos de percepción y adquisición de conocimientos son algo diferentes a los del resto de la población: Las capacidades visuales de los niños con SD son, por ejemplo, superiores a las auditivas, y su capacidad comprensiva es superior a la de expresión, por lo que su lenguaje es escaso y aparece con cierto retraso, aunque compensan sus deficiencias verbales con aptitudes más desarrolladas en lenguaje no verbal, como el contacto visual, la sonrisa social o el empleo de señas para hacerse entender. La atonía muscular determina también diferencias en el desarrollo de la habilidad de caminar, o en la motricidad fina. Todos esos aspectos deben ser contemplados en programas específicos de atención temprana (durante los primeros seis años de vida) para estimular al máximo los mecanismos adaptativos y de aprendizaje más apropiados. Intentar enseñar a leer a un niño con SD utilizando métodos convencionales, por ejemplo, puede convertirse en una tarea muy difícil, si no se tiene en cuenta su superior capacidad visual. Hoy día existen métodos gráficos (a partir de tarjetas, o fichas, que asocian imagen y palabra) que están consiguiendo resultados muy superiores al clásico encadenado de letras en estos niños.44 Además el objetivo de estos programas no es tan sólo la adquisición de habilidades, sino que estas se alcancen mucho antes, permitiendo continuar con programas educativos que integren al máximo a la persona con SD en entornos normalizados.45Vacunaciones
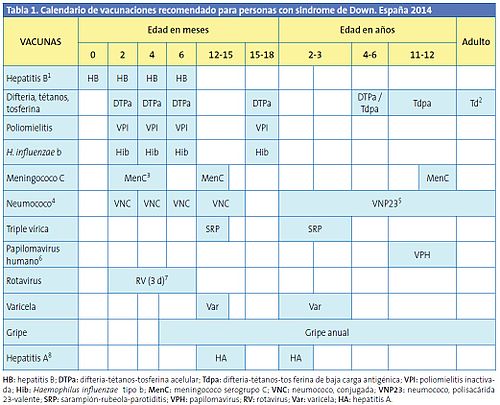
Se enumeran las vacunas recomendables, número de dosis y edades en niños con Sd. de Down (notas al pie: consultar en http://www.pap.es]39
-
- Hepatitis B.
- Difteria, tétanos y tosferina.
- Sarampión, rubeola y parotiditis.
- Poliomielitis.
- Gripe.
- Enfermedad neumocócica.
- Hepatitis A.
- Enfermedad por Haemophilus influenzae tipo b.
- Varicela.
- Rotavirus.
Pronóstico
Se desconocen todavía los mecanismos que provocan la discapacidad en las personas con SD, aunque la secuenciación del genoma humano y diversos estudios llevados a cabo en sujetos con translocaciones parciales están empezando a servir para descubrir los genes responsables del cuadro. Estos mapas fenotípicos también se han comparado con algunos casos de monosomía 21 (cuadro de ausencia de uno de los dos cromosomas del par 21, la situación contraria al SD) obteniéndose así mapas de rasgos asociados al exceso o defecto de dosis cromosómica.47 En las próximas décadas todo este conocimiento sobre el funcionamiento y expresión de los genes permitirá, con seguridad, establecer nuevas estrategias terapéuticas capaces de revertir los trastornos cognitivos asociados al síndrome de Down, y muchos de sus problemas asociados.En 1981 se diseñó el primer Programa de Salud específico para personas con SD, pero el más ampliamente aceptado y difundido en la comunidad científica es el diseñado por el Down Syndrome Medical Interest group (DSMIG).48 En estos programas de salud se contemplan las actuaciones preventivas mínimas para un adecuado diagnóstico precoz y seguimiento de las enfermedades o complicaciones que se pueden presentar, mejorando significativamente el pronóstico de estas personas. Por otra parte los programas, cada vez más extendidos, de estimulación precoz, y el cambio progresivo de mentalidad que la sociedad está experimentando con respecto a la discapacidad intelectual son los principales motivos de la gran transformación que se está viviendo en torno a las personas con SD. Hace apenas unas décadas estas personas eran apartadas de la sociedad en instituciones, o escondidas por sus progenitores, basándose en un falso complejo de culpa. A pesar del enorme esfuerzo que aún queda pendiente se ha comprobado cómo un entorno basado en la aceptación, en la adaptación de los métodos de aprendizaje y en la virtud de la diversidad está dotando a las personas con SD de la autonomía suficiente como para trabajar, vivir en pareja o desarrollar habilidades artísticas impensables hace muy poco tiempo.49
Tabla resumen del programa de salud para personas con síndrome de Down50
Cultura y síndrome de Down
Cine
- Charly (1967) dirigida por Cliff Robertson.
- Johnny palillo (Johnny Stecchino). Roberto Benigni (1991)
- El octavo día (Le huitième jour). Jaco van Dormael (1996)
- Todo por ella (Jewel). Paul Shapiro (2000)
- Tinta roja (película peruana) (Nelson). Francisco Lombardi (2000)
- Yo soy Sam, (2001) dirigida por Jessie Nelson e interpretada por Sean Penn (2001)
- Te quiero, Eugenio dirigida por Francisco José Fernández (2002)51
- El cazador de sueños (Basada en la novela homónima de Stephen King, Dreamcatcher). Lawrence Kasdan (2003)
- León y Olvido (León y Olvido). Xavier Bermúdez (2004)
- Vida y color (Vida y color). Santiago Tabernero (2005)
- Las palabras de Vero (Las palabras de Vero). Octavi Masiá (2005)
- Desayuno en Plutón, 2005) dirigida por Neil Jordan.
- Diario de un escándalo, 2006) dirigida por Richard Eyre
- Yo, también (2009) dirigida por Álvaro Pastor y Antonio Navarro e interpretada por Lola Dueñas y Pablo Pineda.
- Anita (2009) dirigida por Marcos Carnevale e interpretada por Alejandra Manzo.
Literatura
- La niña que nunca creció (The child who never grew) de Pearl S. Buck (1950).
- Los bufones de Dios de Morris West.
- «Los ojos rotos» (relato incluido en Modelos de mujer), Almudena Grandes (1996).
- María Caracolito de Pipo Pescador (1997).
- El mensaje de los pájaros de Joan Manuel Gisbert (2001).
- El cazador de sueños de Stephen King.
- El meu germà Pol de Isabel-Clara Simó.
- El río del Edén de José María Merino.52
- A ira dos mansos (La ira de los mansos) de Manuel Esteban Domínguez. 53
Música
- Mongoloid (1977) de la banda estadounidense Devo. Habla brevemente sobre la vida de una persona con síndrome de Down, a la cual se refieren como un "mongoloide".
Véase también
Referencias
- «http://blog.xerais.gal/destacados/ganadores-dos-xerais-2016/ Premio Xerais Premio Xerais de novela 2016.
Bibliografía
- Siegfried M. Pueschel (2002) Síndrome de Down: Hacia un futuro mejor. Ed. Masson ISBN 1-55766-452-8.
- Down, J.H.L. (1886). «Observations on an ethnic classification of idiots.» London Hospital. Clinical Lectures and Reports, 3: 259-262.
- Corretger, Josep M. et al. (2005). Síndrome de Down: Aspectos médicos actuales. Ed. Masson, para la Fundación Catalana del Síndrome de Down. ISBN 84-458-1504-0.
- Martínez Acebal, Azucena y Joaquín Fernández Toral (1999). Síndrome de Down: Aspectos sociológicos, Médicos y Legales. ISBN 84-86889-65-0.
- Arranz Martínez, Pilar (2002). Niños y jóvenes con Síndrome de Down. Egido Editorial. ISBN 84-95879-09-3.
- Candel, I. Programa de Atención temprana. Intervención en niños con síndrome de Down y otros problemas del desarrollo. Ed. CEPE, Madrid, 1999.








No hay comentarios:
Publicar un comentario